近日,我院藥學(xué)院賈巖龍教授課題組在國(guó)際生物技術(shù)著名期刊《Biotechnology Journal》上發(fā)表題為“Apilimod enhances specific productivity in recombinant CHO cells through cell cycle arrest and mediation of autophagy”的最新研究成果�。該成果以藥學(xué)院為第一作者單位,我院2020屆碩士研究生路江濤為第一作者(現(xiàn)于南開(kāi)大學(xué)攻讀博士學(xué)位)�,賈巖龍教授為通訊作者。
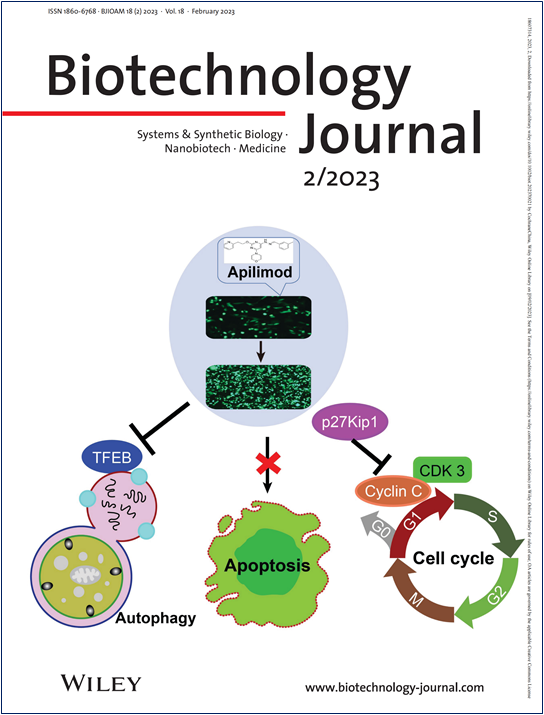
中國(guó)倉(cāng)鼠卵巢(CHO)細(xì)胞是生物醫(yī)藥產(chǎn)業(yè)用于重組蛋白(抗體)藥物生產(chǎn)的最主要宿主平臺(tái)����。針對(duì)CHO細(xì)胞培養(yǎng)中細(xì)胞周期和自噬途徑調(diào)節(jié)細(xì)胞死亡的基因工程因技術(shù)以提高治療性重組藥物蛋白(抗體)的生產(chǎn)而受到關(guān)注�。該研究發(fā)現(xiàn)小分子化合物Apilimod對(duì)CHO細(xì)胞中的重組蛋白表達(dá)具有積極影響,在作用機(jī)制上通過(guò)G0/G1期細(xì)胞周期的選擇性阻斷得到證實(shí)��。添加Apilimod的CHO細(xì)胞通過(guò)降低細(xì)胞周期蛋白依賴性激酶3(CDK3)和細(xì)胞周期蛋白C的表達(dá),同時(shí)促進(jìn)細(xì)胞周期蛋白激酶抑制劑p27Kip1的轉(zhuǎn)錄和蛋白表達(dá)水平����,這是G1細(xì)胞周期進(jìn)展的關(guān)鍵調(diào)節(jié)因子和控制細(xì)胞增殖的重要靶點(diǎn)。此外��,TFEB作為調(diào)節(jié)自噬和溶酶體生物發(fā)生的關(guān)鍵轉(zhuǎn)錄因子����,Apilimod處理后抑制了TFEB的表達(dá),導(dǎo)致溶酶體生物發(fā)生和自噬受損�����。這些多重效應(yīng)顯示了Apilimod作為CHO細(xì)胞工程中生產(chǎn)重組蛋白的新增強(qiáng)子的潛力����。
據(jù)悉,《Biotechnology Journal》期刊最新分區(qū)是中科院二區(qū)�,2022年最新影響因子為5.726。
全文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/biot.202200147
(圖文:賈巖龍)